 В статье детально рассмотрены важные изменения в Правилах обязательного медицинского страхования, которые вступили в силу в 2016 году.
В статье детально рассмотрены важные изменения в Правилах обязательного медицинского страхования, которые вступили в силу в 2016 году.
Напомним, что данные правила являются приложением к приказу Минздравсоцразвития РФ № 158-н от 28.02.2011 года.
Рассмотрены Правила ОМС 2016 года в редакции от 16 мая 2016 года.
Заявление о выборе страховой медицинской организации
В п. 1 ч. 6 Правил ОМС изменен состав сведений, которые должны быть указаны в заявлении.
В частности, ранее номер СНИЛС (номер индивидуального учета в системе пенсионного страхования) предъявлялся гражданами при его наличии, теперь же его наличие и указание регистрационного номера является обязательным.
Исключение предусмотрено для иностранных граждан и лиц без гражданства – они представляют сведения о СНИЛС лишь при его наличии.
Корреспондируют п. 1 ч. 6 и изменения, внесенные в п. 1 части 9 Правил об ОМС, в которых среди прилагаемых к заявлению документов содержится и СНИЛС.
В ранее действовавшей редакции СНИЛС прилагался к заявлению при его наличии.
Аналогичные сведения об обязательном предоставлении СНИЛС внесены также в п. 3 ч. 3 Правил, в котором говорится об электронном страховом приложении, а также в п. 1 ч. 56, посвященном оформлению дубликата полиса ОМС.
Изменение анкетных данных застрахованных лиц
В части 52 Правил указаны те сведения, при изменении которых застрахованное лицо обязано уведомить об этом страховую медицинскую организацию.
В новой редакции Правил исключено положение об уведомлении гражданином страховой организации в случае изменения данных документа, удостоверяющего личность (паспорта).
Теперь в случае изменения паспортных данных переоформление полиса ОМС не требуется, он должен быть заменен лишь в случае изменения фамилия, имени или отчества гражданина, что прямо указано в ч. 52.
Информационное сопровождение застрахованных лиц
В ч. 65 перечислена информация, с которой страховые медицинские организации должны ознакомить застрахованных лиц при получении полиса ОМС.
Добавлено положение о том, что одновременно с выдачей полиса, страховая организация должна проинформировать застрахованное лицо о порядках информационного сопровождения на всех этапах оказания ему медпомощи.
Напомним, что помимо этого страховая организация должна разъяснить гражданину его права в сфере медицинского страхования, предоставить ему памятку с контактными телефонами территориального фонда ОМС и страховой медицинской организации, которая выдала полис.
Уведомление о получение медучреждениями лицензии на осуществление деятельности в сфере ОМС
Обширные изменения в Правила ОМС внесены в часть 92.
Данная часть Правил посвящена медучреждениям, которые получили право на осуществление деятельности в сфере ОМС (лицензию).
Изменения касаются содержания уведомления о включении медучреждения в реестр медицинских организаций, осуществляющих деятельность в сфере обязательного медицинского страхования.
В частности, ранее в такое уведомление в обязательном порядке включались общие сведения, а именно:
- краткое и полное наименование медучреждения;
- ФИО индивидуального предпринимателя, осуществляющего медицинскую деятельность; адрес места нахождения медучреждения или индивидуального предпринимателя, осуществляющего медицинскую деятельность;
- сведения об организационно-правовой форме медучреждения;
- номера КПП и ИНН медучреждения
- сведения о лицензии на осуществление медицинской деятельности и виды медпомощи, которая оказывается в рамках территориальной программы;
- контактные данные медучреждения и его руководителей.
В новой редакции Правил ОМС, которая вступила в силу с 16 мая 2016 года, в такое уведомление обязательно дополнительно включить следующие сведения:
- сведения о мощности коечного фонда медучреждения и ее профилей;
- сведения о мощности медучреждения и его отделений, которые оказывают первичную медпомощь в разрезе врачей-специалистов и профилей;
- фактически оказанные за предыдущий год объемы медпомощи по КСГ и КПГ по взрослому и детскому населению, а также объемы их финансирования. Эти сведения представляются на основании данным статистического и бухгалтерского учета медучреждения;
- численность прикрепленных к медучреждению застрахованных лиц, которые выбрали медучреждение для оказания первичной медпомощи, в разрезе половозрастных групп;
- предложения о планируемых показателях по объему медпомощи на плановый год в разрезе профилей оказания медпомощи, врачей-специалистов, а также количеству вызовов СМП, КСГ и КПГ по взрослому населению.
Акт сверки расчетов
В части 121 Правил скорректирован перечень сведений, которые должны содержаться в акте сверки расчетов страховой медицинской организации и территориального фонда ОМС, который составляется ежемесячно.
В частности, исключены пп. «г» и «д» п. 5 ч. 121, которые были ранее включены дополнительно в 2013 году.
В них предусматривалось отражение в акте сверки расчетов средств экономии, полученных в соответствии с договором о финансовом обеспечении ОМС, а также средств для выплаты вознаграждений страховой организации за выполнение целевых показателей доступности и качества медпомощи.
п. 7 ч. 121 изложен в новой редакции.
Теперь в акте сверки расчетов должны быть отражены средства, которые получены страховщиками от применения к медучреждениям санкций за выявленные нарушения, направленные в территориальной фонд.
К этим средствам законодателем отнесены:
- средства, полученные по результатам медико-экономического контроля;
- средства, полученные по результатам медико-экономической экспертизы;
- средства, полученные по результатам экспертизы качества медпомощи;
- средства, полученные по результатам оплаты медучреждением штрафов за несвоевременное оказание, неоказание медпомощи, а также за оказание медпомощи ненадлежащего качества.
В ч. 132, посвященной направлению акта сверки расчетов между медицинской организацией и страховой медицинской организацией, также внесены изменения.
В п. 3 ч. 132 изменилась формулировка: заменено «сумма средств, удержанных…» на «сумма средств, сформированная на нарушения…».
Кроме того, добавлен пункт 3.1., в котором предусмотрено отражение в акте суммы средств, которые удержаны у медучреждения по результатам проверок предоставления медпомощи (результаты медико-экономического контроля, медико-экономической экспертизы и экспертизы качества медпомощи).
Определение размера неполной оплаты затрат на медпомощь
В части 127.4 приведена формула, по которой рассчитывается общий размер неполной оплаты (неоплаты) медучреждениями затрат на оказание медпомощи.
В данной части скорректирован код дефекта для коэффициента неполной оплаты. В частности, коэффициенту 0,8 в новой редакции соответствует код дефекта 3,6 (ранее 3,8).
Сроки направления повторных счетов на оплату медпомощи
В ч. 128 изменены формулировки, касающиеся предоставления в страховую организацию доработанных и отклоненных ранее счетов на оплату медпомощи и реестров счетов.
Срок предоставления остался прежним – до рабочих 25 дней (ранее в Правилах был указан прописными буквами, теперь – цифрами), указано, что акт, полученный от страховой медицинской организации, сформирован на основе результатов медико-экономического контроля представленного медучреждением счета на оплату медпомощи.
Нормированный страховой запас
В ч. 131.1 исключены положения, согласно которым ранее территориальный фонд ОМС направлял в страховые организации и медучреждения средства нормированного запаса для выплаты вознаграждений страховым организациям и медучреждениям за выполнение целевых значений доступности и качества медпомощи.
В новой редакции средства нормированного запаса также направляются страховщикам и медучреждениям, однако не указано их целевое назначение.
www.zdrav.ru
 Участники Ассоциации международных фармпроизводителей (AIPM) отчитались о выплатах российским врачам, ученым и медицинским организациям. «Подобное раскрытие информации по выплатам впервые происходит в России, хотя подобная практика уже давно применяется за рубежом, в соответствии с кодексами AIPM и Европейской федерации фармацевтической промышленности и ассоциаций», – пояснил представитель GlaxoSmithKline (GSK).
Участники Ассоциации международных фармпроизводителей (AIPM) отчитались о выплатах российским врачам, ученым и медицинским организациям. «Подобное раскрытие информации по выплатам впервые происходит в России, хотя подобная практика уже давно применяется за рубежом, в соответствии с кодексами AIPM и Европейской федерации фармацевтической промышленности и ассоциаций», – пояснил представитель GlaxoSmithKline (GSK).
 При Комитете по охране здоровья ГД РФ создана рабочая группа по редким заболеваниям. По словам ее председателя, депутата Госдумы Разиет Натхо, комитет займется проблемами финансирования лекарственного обеспечения пациентов, страдающих редкими заболеваниями.
При Комитете по охране здоровья ГД РФ создана рабочая группа по редким заболеваниям. По словам ее председателя, депутата Госдумы Разиет Натхо, комитет займется проблемами финансирования лекарственного обеспечения пациентов, страдающих редкими заболеваниями. Всего несколько лет работы научных центров по всему миру принесли медицине новое направление – безинтерфероновую терапию хронического гепатита С (ХГС), которая включает комбинации лекарственных препаратов из разных групп с целью повышения эффективности терапии и снижения побочных реакций, характерных для интерфероновых схем. С середины 2015 года внедрение безинтерфероновой терапии в лечении ХГС началось и в России.
Всего несколько лет работы научных центров по всему миру принесли медицине новое направление – безинтерфероновую терапию хронического гепатита С (ХГС), которая включает комбинации лекарственных препаратов из разных групп с целью повышения эффективности терапии и снижения побочных реакций, характерных для интерфероновых схем. С середины 2015 года внедрение безинтерфероновой терапии в лечении ХГС началось и в России. Определить акционерное общество «Национальная иммунобиологическая компания» единственным поставщиком лекарственных препаратов, полученных из плазмы крови человека и животных, закупка которых осуществляется в 2016 и 2017 годах Минздравом России, Минобороны России, МЧС России, МВД России, Минобрнауки России, ФСБ России, ФМБА России, ФАНО России, ФТС России, ФСИН России, Росрезервом, Росавиацией и подведомственными им, а также Управлению делами Президента Российской Федерации федеральными государственными бюджетными и казенными учреждениями, по перечню согласно приложению № 1
Определить акционерное общество «Национальная иммунобиологическая компания» единственным поставщиком лекарственных препаратов, полученных из плазмы крови человека и животных, закупка которых осуществляется в 2016 и 2017 годах Минздравом России, Минобороны России, МЧС России, МВД России, Минобрнауки России, ФСБ России, ФМБА России, ФАНО России, ФТС России, ФСИН России, Росрезервом, Росавиацией и подведомственными им, а также Управлению делами Президента Российской Федерации федеральными государственными бюджетными и казенными учреждениями, по перечню согласно приложению № 1 Швейцарская компания Novartis намерена к 2020 году почти утроить количество представленных на рынке биоаналогов, пишет
Швейцарская компания Novartis намерена к 2020 году почти утроить количество представленных на рынке биоаналогов, пишет  «Национальная иммунобиологическая компания» («Нацимбио») госкорпорации «Ростех» в рамках Санкт-Петербургского экономического форума (ПМЭФ-2016) подписала с индийской компанией «Cipla» соглашение о переносе технологий производства фармсубстанций и комбинированных препаратов для лечения ВИЧ-инфекции и вирусных гепатитов. Об этом говорится в пресс-релизе компании, имеющемся в распоряжении «Ленты.ру».
«Национальная иммунобиологическая компания» («Нацимбио») госкорпорации «Ростех» в рамках Санкт-Петербургского экономического форума (ПМЭФ-2016) подписала с индийской компанией «Cipla» соглашение о переносе технологий производства фармсубстанций и комбинированных препаратов для лечения ВИЧ-инфекции и вирусных гепатитов. Об этом говорится в пресс-релизе компании, имеющемся в распоряжении «Ленты.ру». Заказчик имеет право на закупку по ТНН только по индивидуальным показаниям, по решению врачебной комиссии для одного пациента на 1 полный курс лечения.
Заказчик имеет право на закупку по ТНН только по индивидуальным показаниям, по решению врачебной комиссии для одного пациента на 1 полный курс лечения. По данным аудита льготного лекарственного обеспечения фармацевтического рынка России (ОНЛС/ВЗН), проводимого DSM Group, за 1 квартал 2016 года по программе ЛЛО было закуплено 23 миллиона упаковок лекарственных средств на сумму 42,6 миллиарда рублей. В сравнении с первыми тремя месяцами 2015 года объемы закупок в упаковках сократились на 10,5%, в рублях — на 12,5%.
По данным аудита льготного лекарственного обеспечения фармацевтического рынка России (ОНЛС/ВЗН), проводимого DSM Group, за 1 квартал 2016 года по программе ЛЛО было закуплено 23 миллиона упаковок лекарственных средств на сумму 42,6 миллиарда рублей. В сравнении с первыми тремя месяцами 2015 года объемы закупок в упаковках сократились на 10,5%, в рублях — на 12,5%. В ТОР-10 брендов по натуральным объемам продаж изменения не столь значительны. На первом месте бренд «Ацекродол». На втором месте – бренд «Лизиноприл-Тева», значительно увеличивший объемы закупки в упаковках (в 7,5 раз). Третье место занимает бренд «Верошпилактон».
В ТОР-10 брендов по натуральным объемам продаж изменения не столь значительны. На первом месте бренд «Ацекродол». На втором месте – бренд «Лизиноприл-Тева», значительно увеличивший объемы закупки в упаковках (в 7,5 раз). Третье место занимает бренд «Верошпилактон».
 Использование противовирусных препаратов прямого действия способствует значительному повышению эффективности терапии и снижению смертности от хронического гепатита С (ХГС). Обширный пласт вопросов, связанных с современным ведением трудных пациентов с этим широко распространенным заболеванием обсудили ведущие специалисты России, США, Франции, Великобритании, Италии, Германии и Польши в рамках 8-й международной конференции «Белые ночи гепатологии», которая состоялась в Санкт-Петербурге 2-3 июня под эгидой Европейской Ассоциации по изучению печени (EASL).
Использование противовирусных препаратов прямого действия способствует значительному повышению эффективности терапии и снижению смертности от хронического гепатита С (ХГС). Обширный пласт вопросов, связанных с современным ведением трудных пациентов с этим широко распространенным заболеванием обсудили ведущие специалисты России, США, Франции, Великобритании, Италии, Германии и Польши в рамках 8-й международной конференции «Белые ночи гепатологии», которая состоялась в Санкт-Петербурге 2-3 июня под эгидой Европейской Ассоциации по изучению печени (EASL). Цены на лекарства в России формируются согласно законодательству, компания Roche при формировании стоимости своих лекарств ориентируется на соответствующие нормативные акты. Об этом рассказал генеральный директор «Рош-Москва» Ненад Павлетич.
Цены на лекарства в России формируются согласно законодательству, компания Roche при формировании стоимости своих лекарств ориентируется на соответствующие нормативные акты. Об этом рассказал генеральный директор «Рош-Москва» Ненад Павлетич. В сравнении с первыми тремя месяцами прошлого года объёмы закупок в упаковках упали на 11%, а в рублях на 8%.
В сравнении с первыми тремя месяцами прошлого года объёмы закупок в упаковках упали на 11%, а в рублях на 8%.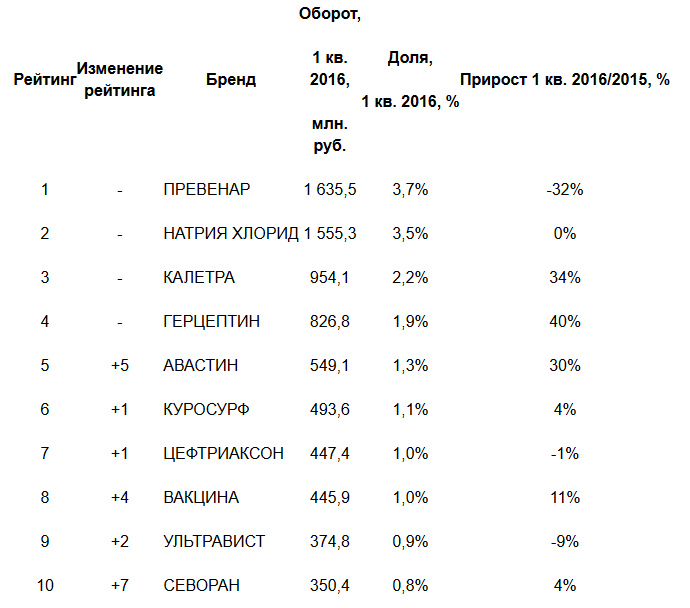
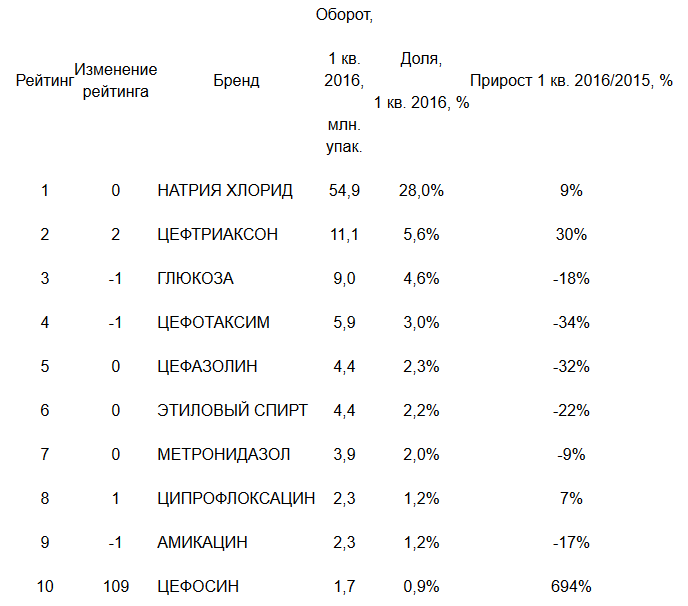 «Госпитальные закупки менее подвержены сезонным факторам в отличие от аптечных продаж. В большей мере на поставки в МО влияют сроки проведения тендера и график поставки. Поэтому по итогам года мы можем увидеть совершенно другую картину в распределении объёмов в рублях и в упаковках между производителями и их препаратами», — говорит эксперт фармацевтического рынка, генеральный директор DSM Group Сергей Шуляк.
«Госпитальные закупки менее подвержены сезонным факторам в отличие от аптечных продаж. В большей мере на поставки в МО влияют сроки проведения тендера и график поставки. Поэтому по итогам года мы можем увидеть совершенно другую картину в распределении объёмов в рублях и в упаковках между производителями и их препаратами», — говорит эксперт фармацевтического рынка, генеральный директор DSM Group Сергей Шуляк.
 Главное, что понимаешь в ходе общения с водопроводчиками и электриками — если человек занимается чем-то 20 лет, это еще не значит, что он умеет это делать.
Главное, что понимаешь в ходе общения с водопроводчиками и электриками — если человек занимается чем-то 20 лет, это еще не значит, что он умеет это делать. В статье детально рассмотрены важные изменения в Правилах обязательного медицинского страхования, которые вступили в силу в 2016 году.
В статье детально рассмотрены важные изменения в Правилах обязательного медицинского страхования, которые вступили в силу в 2016 году. Руководители – главные эксперты по медико-социальной экспертизе (МСЭ) по Москве и Липецкой области уволены после жалоб жителей регионов на их неподобающее поведение.
Руководители – главные эксперты по медико-социальной экспертизе (МСЭ) по Москве и Липецкой области уволены после жалоб жителей регионов на их неподобающее поведение. Верховный суд России отказался отменить обязательные ежегодные проверки на ВИЧ для медработников, работающих в хирургии, передает
Верховный суд России отказался отменить обязательные ежегодные проверки на ВИЧ для медработников, работающих в хирургии, передает  Одним из серьезных механизмов влияния на главного врача медицинской организации является оплата труда.
Одним из серьезных механизмов влияния на главного врача медицинской организации является оплата труда. Приказом Минздрава России от 05.05.2016 N 282н утвержден Порядок проведения экспертизы профпригодности, а также форма медицинского заключения.
Приказом Минздрава России от 05.05.2016 N 282н утвержден Порядок проведения экспертизы профпригодности, а также форма медицинского заключения. В мае 2016 года группа компаний «Р-Фарм» получила регистрационное удостоверение ЛП-003622 от 12.05.2016 МЗ РФ на препарат нарлапревир. Препарат, представляющий собой ингибитор протеазы нового поколения, предназначен для лечения хронического гепатита С (генотип 1) в комбинации с другими противовирусными препаратами.
В мае 2016 года группа компаний «Р-Фарм» получила регистрационное удостоверение ЛП-003622 от 12.05.2016 МЗ РФ на препарат нарлапревир. Препарат, представляющий собой ингибитор протеазы нового поколения, предназначен для лечения хронического гепатита С (генотип 1) в комбинации с другими противовирусными препаратами. 